Книги по аквариумистике
Лучшая on-line библиотека для начинающих и профессионалов!
Виды связей в атоме
В хлориде натрия (поваренной соли) химическая связь называется ионной или гетерополярной связью. В этом виде связи электроны одного атома, которые образуют связь, находятся в оболочке другого атома. В нашем примере натрий имеет на внешней орбите один электрон и стремится его отдать для того, чтобы приобрести стабильную оболочку ближайшего инертного газа (неона). Конфигурация атомов инертных газов особенно стабильна, что подтверждается тем, что их атомы при нормальных условиях почти не образуют соединений. Атом хлора, напротив, на внешней электронной оболочке имеет семь электронов и стремится получить один электрон, чтобы достигнуть стабильного состояния инертного газа аргона. Благодаря обмену электронов атомы приобретают заряд.
Атом натрия отдает отрицательно заряженный электрон. Он приобретает поэтому положительный заряд, в то время как атом хлора, благодаря полученному электрону, становится соответственно отрицательно заряженным.
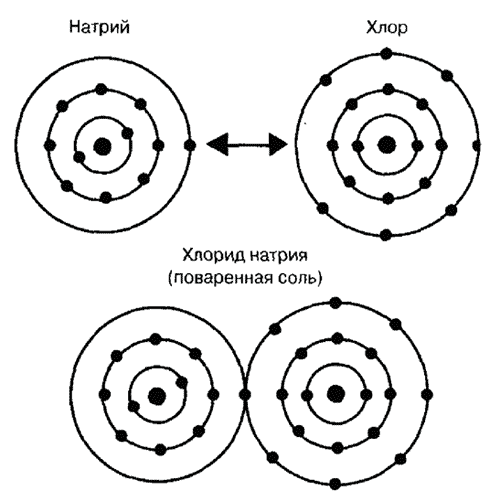
Ионная связь на примере поваренной соли (хлорид натрия)
Другой вид связи – ковалентная связь. Типичный пример – соединение двух атомов кислорода в молекулу кислорода. Каждому атому кислорода до оболочки следующего инертного газа не хватает двух электронов. Четыре из двенадцати электронов на внешних орбитах обоих атомов образуют совместную электронную пару. Вследствие этого каждый атом кислорода получает заполненную внешнюю орбиту, так как ее электроны принадлежат одновременно обоим атомам. Такая связь между двумя электрически нейтральными атомами называется атомной или ковалентной.
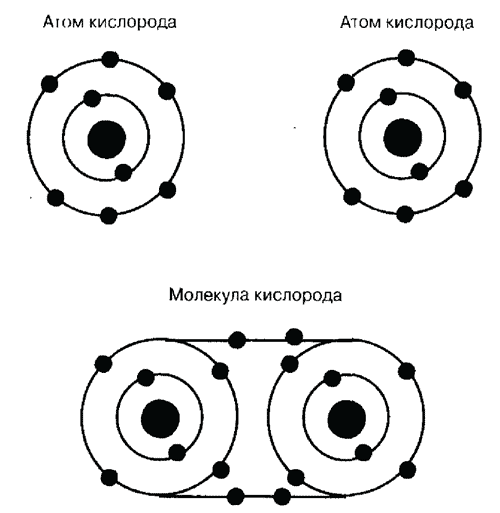
Ковалентная связь на примере кислорода
Еще один вид связи – металлическая связь. Металлы отличаются тем, что на внешних электронных орбитах они имеют только отдельные электроны. Только через отдачу электронов металл может получить строение атомной оболочки ближайшего идеального газа. Эти электроны образуют между положительно заряженными атомами металлов отрицательно заряженное электронное облако, и таким образом они находятся вместе. Этим видом связи объясняется хорошая электрическая проводимость металлов, так как в наличии постоянно имеются электроны для переноса заряда.
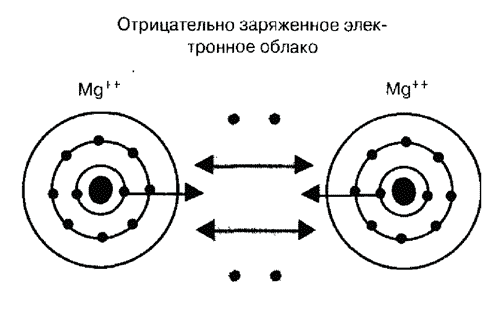
Для металлической связи (на примере магния) характерным является то, что отдельные электроны образуют электронное облако
Предыдущая || Следующая || Оглавление